Les protéines de cellules hôtes (HCP), provenant de cellules modifiées dans la production biopharmaceutique, peuvent potentiellement avoir un impact sur la qualité, l'efficacité et la sécurité du produit. Par conséquent, la surveillance HCP constitue un attribut de qualité critique (CQA) dans le processus de fabrication. Compte tenu de la grande diversité des PCH, de multiples techniques de détection et d'identification sont nécessaires pour satisfaire aux normes réglementaires mondiales.
1. Plate-forme de technologie d'analyse et de détection HCP (ELISA 、 LC-MS et 2D)
A. SHENTEK®Kit HCP ELISAPersonnalisé selon une technique spécifique pour assurer une détection précise et ciblée.
B. Système de traçabilité des normes HCP ELISA pour assurer la précision et la fiabilité du test.
C. Évaluer avec précision les HCP spécifiques au processus et à haut risque et les variations des HCP entre les lots, tels que les lots d'essais précliniques et cliniques.
D. Identifier les HCP à haut risque en utilisant des techniques orthogonales pour compléter les limites HCP ELISA pour le développement des bioprocédés.
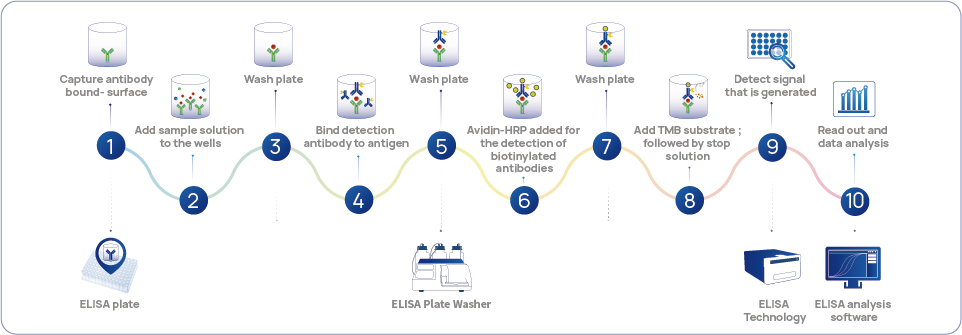
Figure 1 Technologie standard HCP-Flux de travail de détection ELISA
2. Plate-forme d'analyse de couverture d'anticorps HCP (IMBS-2D et IMBS/LC-MS)
A. IMBS®Technologie (séparation des billes immunomagnétiques) basée sur des complexes immuns antigène-anticorps-billes magnétiques pour une séparation rapide d'antigènes spécifiques.
B. 2D et LC-MS offrent une représentation multi-angle, précise et objective du degré d'appariement entre les anticorps et les HCP.
C. La spécificité des anticorps HCP est mesurée par une analyse de couverture sur des échantillons de processus simulés ou à un stade précoce.
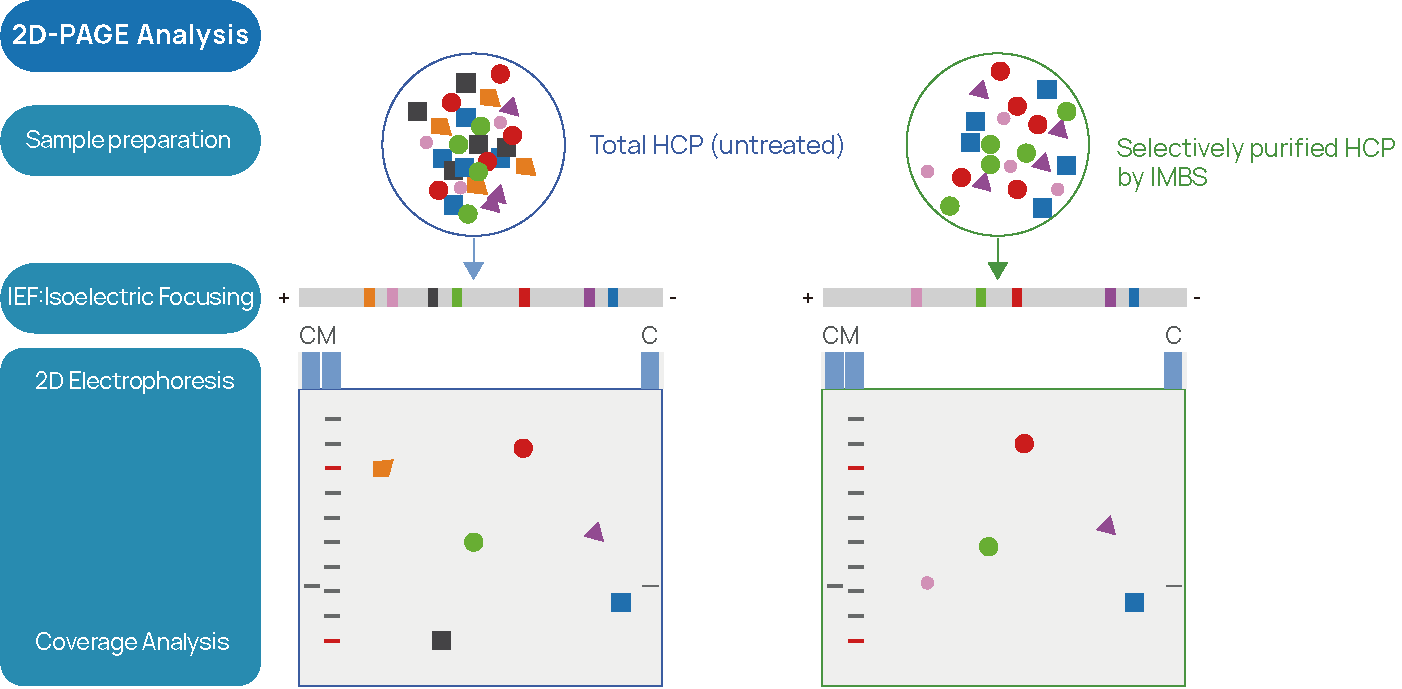
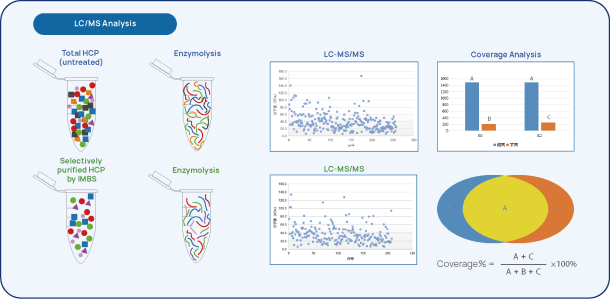
Figure 2 IMBS-2D et IMBS-LC/MS HCP-Analyse de la couverture des anticorps
3. plate-forme de préparation d'anticorps polyclonal HCP
A. Personnaliser les voies immunitaires et les stratégies pour différents antigènes.
B. Surveiller la préparation d'anticorps de haute qualité avec une caractérisation précise des anticorps tout au long du processus.
C. Une plate-forme de préparation d'anticorps normalisée multimode pour assurer la génération d'anticorps avec un taux de couverture et une efficacité élevés.
D. Assurer la fiabilité et la comparabilité du système de détection grâce au système de traçabilité des produits de référence HCP.
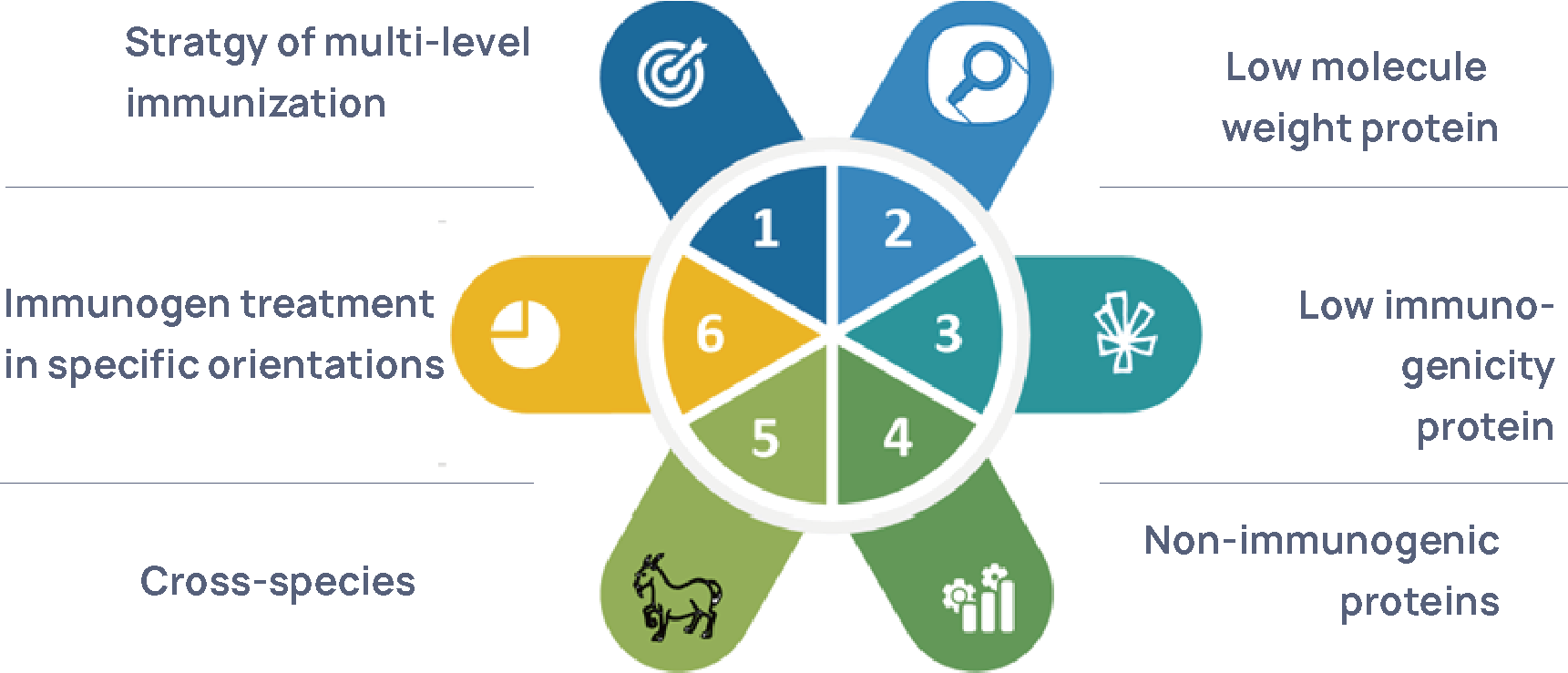
Figure 3 Plate-forme de préparation d'anticorps polyclonaux HCP
4. plate-forme adaptée aux besoins du client HCP ELISA Kit
A. Études approfondies des normes HCP résiduelles (RHCP) pour obtenir une couverture et une spécificité excellentes.
B. Pratique standard de traçabilité de référence du HCP pour assurer la fiabilité des dosages immunologiques.
C. Stratégies efficaces et intensives de préparation d'antigènes et d'anticorps pour une réponse immunitaire robuste et des anticorps polyclonaux de haute qualité.
D. Conformité avec le système de qualité ISO13485 pour garantir le développement de kit HCP ELISA de haute qualité.
E. Conformité avec les normes de qualité CNAS/ISO10725 et GMP pour assurer l'intégrité du service et des produits.
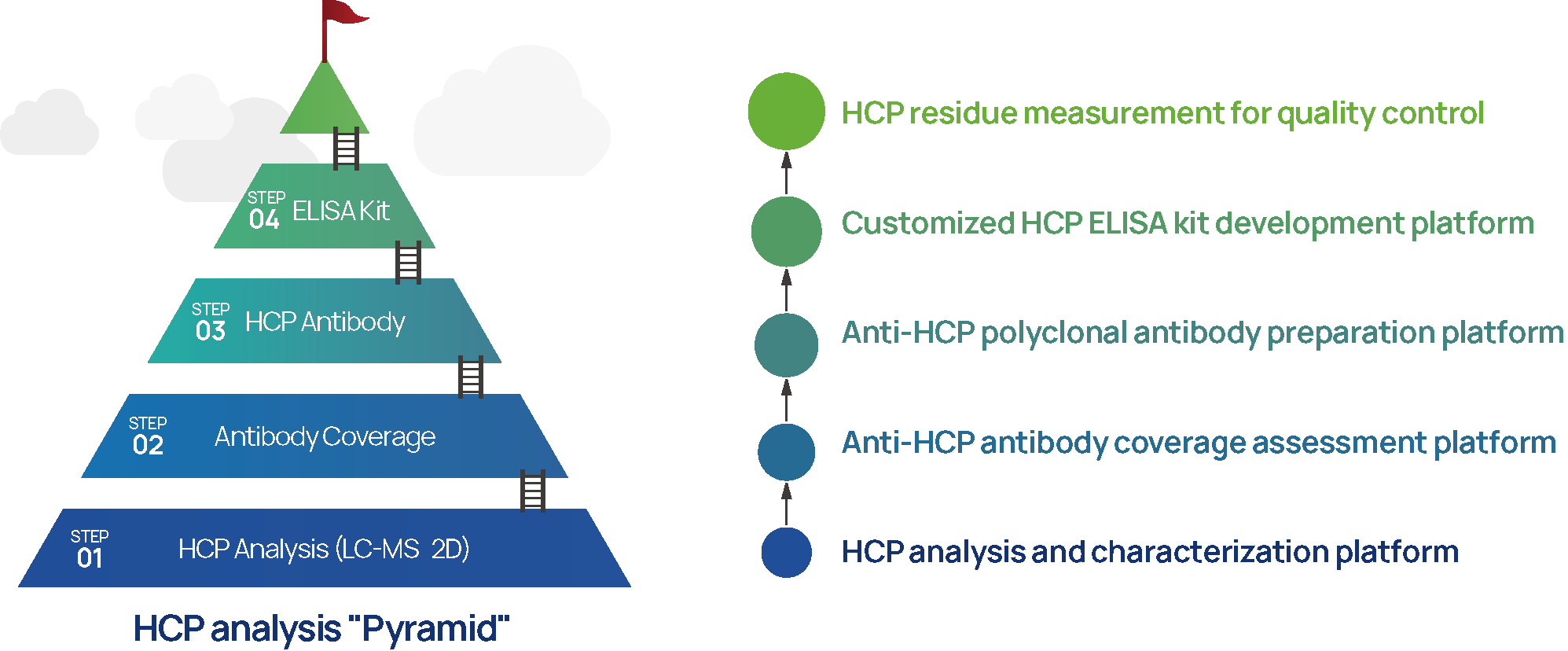
Figure 4: Plateformes de service d'analyse des protéines de cellules hôtes SHENTEK